( VISITA http://leonardouniverso.blogspot.com )
Bienvenidos al origen del Universo! Estamos en el instante inicial de un hoy sin ayer. Tiempo: 10-43 s, tiempo de Plank; menos de una septillonésima de segundo tras el Inicio de las cosas. En esta etapa, el Universo es extraordinariamente simple: no existe ni materia, ni energía. Tan sólo un miserable e ínfimo espacio vacío. Su tamaño es millones de veces más pequeño que el de un átomo: si viajáramos en línea recta por él, volveríamos al punto de partida tras recorrer apenas 10-20 cm. Nos encontramos en la etapa llamada Falso Vacío, punto de partida de nuestro viaje por el reino de la complejidad creciente y el momento de mayor simplicidad del Universo.
¿Que había unos instantes antes? Hoy día, nuestros conocimientos científicos no bastan para responder a esta pregunta. Antes del tiempo de Plank, el Universo era tan sumamente extraño y diferente a nada que podamos estudiar en laboratorios o aceleradores de partículas, que nuestra ciencia falla por completo. Ninguna de las leyes de la física que conocemos es aplicable a ese intervalo. El tiempo de Plank es el intervalo de tiempo más pequeño que se puede considerar con algún significado físico. No existe ningún proceso conocido que tenga una duración igual o menor a ese intervalo de tiempo. Pensar qué pudo haber antes de ese instante quizá no tenga siquiera un significado real. Es posible que antes del origen del Universo no hubiera ni siquiera un "antes", ya que, por lo que sabemos, todo, incluido el propio tiempo, surgió en la gran explosión.
En las condiciones tan extremas que reinaban en el inicio del Universo no podemos aplicar las leyes cotidianas de la física. Ni siquiera la teoría de la gravitación de Einstein que hemos usado para describir la topología global del Universo es adecuada. En esos momentos iniciales, el comportamiento del Universo estaba dominado por la Física de Partículas y especialmente por la Teoría Cuántica de Campos. Por este motivo, si queremos entender cómo, a partir de esa etapa de sencillez máxima, el Universo aumentó su complejidad permitiendo la aparición de estructuras como las galaxias, los planetas y los seres vivos, merece la pena que empleemos unos instantes en resumir lo que la física de partículas tiene que decirnos sobre la naturaleza de las cosas.
Todo lo que compone el Universo está formado por partículas inconcebiblemente pequeñas. La enorme complejidad que nos envuelve es en realidad el resultado de la combinación e interacción de unos pocos constituyentes fundamentales. Nuestros cuerpos están formados por diminutas moléculas que se hallan a su vez compuestas de unas minúsculas partículas a las que conocemos como átomos (del griego 'a - tomo', indivisible). El químico británico John Dalton postuló en el siglo XIX que todas las sustancias químicas podían explicarse a partir de la combinación en proporciones sencillas de 26 átomos distintos e indivisibles. Fue el nacimiento de la química moderna. A las sustancias que están formadas por un único tipo de átomo se las conoce como elementos. Este es el caso por ejemplo del oro.
Mapa I de la Realidad
Con posterioridad se descubrieron más elementos químicos y se estudiaron sus propiedades. En 1871, cuando ya se conocían 62 elementos, el químico ruso Dimitri Ivánovich Mendeléiev descubrió que, si se ordenaban los elementos por su peso, existía algún tipo de patrón y orden respecto a sus propiedades químicas. Mendeléiev ordenó los elementos en forma de tabla y publicó sus resultados en 1869. La tabla periódica desvelaba un orden oculto en la materia.
Tabla periódica de los elementos original de Mendeléiev
Mendeléiev había dejado algunos huecos en blanco en su tabla correspondientes a elementos hipotéticos completamente desconocidos. Según su tabla debían existir con una masa y unas propiedades químicas muy concretas. Sus teorías sobre la existencia de tal orden en las propiedades de los elementos químicos fueron ampliamente aceptadas cuando se descubrieron tres de esos elementos predichos: el escandio, el galio y el germanio.
¿Pero a qué se debe que exista ese orden en las propiedades de los indivisibles átomos? Pues precisamente a que no son indivisibles. Las pequeñas partículas llamadas átomos están en realidad formadas por partículas aún más pequeñas. Las primeras evidencias de la existencia de partículas más pequeñas que el átomo llegaron en 1897, cuando el físico J. J. Thomson, investigando los recién descubiertos rayos catódicos, determinó que éstos estaban formados por partículas con carga eléctrica negativa y con una masa de tan sólo 9,1x10-28 g. Bautizó estas partículas con el nombre de electrones (e-). Un año antes se había descubierto la radioactividad: los elementos químicos radiactivos emitían tres tipos de radiación diferentes, alfa, beta y gamma, compuestas de partículas muy energéticas y con propiedades distintas. Ambos fenómenos, la existencia del electrón y la radioactividad, levantaron la sospecha de que el átomo no era verdaderamente indivisible.
La confirmación llegó en 1911. El físico neozelandés Ernest Rutherford, estudiando cómo la radiación alfa era desviada por una fina lámina de oro, dedujo que la mayor parte de la masa de un átomo está concentrada en una minúscula región con carga positiva, el núcleo. El núcleo es tan pequeño en comparación con el tamaño del átomo que si tomamos una pelota de fútbol como tamaño a escala de un núcleo (unos 30 cm de diámetro) la superficie de un campo de fútbol de 30 Km de largo sería el tamaño correspondiente del átomo. Mucho campo para tan poca pelota. Los electrones se hallarían girando alrededor de este núcleo como si de un microsistema solar se tratase. Ocho años después, Rutherford obtuvo núcleos de átomos de hidrógeno. Como el hidrógeno era el átomo más ligero conocido, lo bautizó con el nombre de protón (p+), que significa el primero. Hoy sabemos que el protón es una partícula de carga positiva y masa igual a 1,67 x10-24 g. Un protón pesa por tanto 1836 veces más que un electrón. Se demostraba así que los átomos estaban compuestos de protones de carga positiva encerrados en un núcleo que era 1015 veces menor que el propio átomo, y de electrones distribuidos alrededor del mismo. Las diferencias entre los átomos de los distintos elementos químicos se debe tan sólo a que cada uno tiene una cantidad diferente de protones y de electrones. Además, las propiedades químicas de los átomos son debidas principalmente a los electrones que componen la zona exterior del átomo. Éstos se distribuyen por capas con una cierta periodicidad, lo que explica la periodicidad que descubrió Mendeleiev en las propiedades químicas de los elementos.
Pero si sólo se tenía en cuenta los protones y los electrones, la mayoría de los átomos parecían pesar el doble de lo esperado. En 1920 Rutherford sugirió que el núcleo debía contener otra partícula, sin carga eléctrica y de masa similar al protón. Bautizó a esta hipotética partícula con el nombre de neutrón. En 1932 J. Chadwick determinó experimentalmente su masa. Era ligeramente mayor que la del protón y el electrón juntos. Con su descubrimiento quedó completada la primera imagen de detalle del átomo. Estos componentes de la materia que originariamente se creían indivisibles y fundamentales, resultaban estar compuestos en realidad por tres tipos de partículas: el electrón, de carga negativa, el protón, de carga positiva y el neutrón, sin carga.
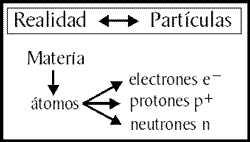
Mapa II de la Realidad


